| Jeśli ta wiadomość nie wyświetla się poprawnie, kliknij tutaj. |
| Poniższa wiadomość przeznaczona jest wyłącznie dla lekarzy. Treści i linki zawarte w tym e-mailu mogą mieć charakter promocyjny, a dostęp do nich jest prawnie ograniczony |
 |
 |
Trulicity® to pierwszy i jedyny agonista receptora GLP-1, który istotnie redukuje ryzyko wystąpienia poważnych zdarzeń sercowo-naczyniowych u pacjentów z cukrzycą typu 2 i czynnikami ryzyka tych zdarzeń, zarówno z rozpoznaną, jak i bez rozpoznanej choroby sercowo-naczyniowej1,2. |
|
Trulicity® zmniejsza o 12% ryzyko zdarzeń sercowo-naczyniowych (MACE-3*) w grupie pacjentów, u których w większości takie zdarzenia nie wystąpiły1,2.
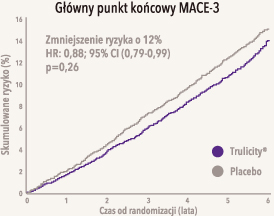
*MACE-3 = zawał serca niezakończony zgonem, udar mózgu niezakończony zgonem lub śmierć z powodów sercowo-naczyniowych. Produkt leczniczy Trulicity jest wskazany w leczeniu osób dorosłych z niedostatecznie kontrolowaną cukrzycą typu 2 jako uzupełnienie diety i ćwiczeń: - w monoterapii - gdy stosowanie metforminy uważa się za niewłaściwe z powodu nietolerancji lub przeciwwskazań; - w leczeniu uzupełniającym - w skojarzeniu z innymi produktami leczniczymi stosowanymi w leczeniu cukrzycy. Wyniki badań dotyczące leczenia skojarzonego, wpływu na kontrolę glikemii, zdarzeń niepożądanych związanych z układem sercowo-naczyniowym i badanych populacji przedstawiono w punktach 4.4, 4.5 i 5.1 charakterystyki produktu leczniczego Trulicity1 . |
|
||||||||||
 |
Wysoka skuteczność w prostym podaniu1,3. |
||
 |
| 1. Trulicity®, Charakterystyka Produktu Leczniczego, październik 2019. 2. Gerstein H.C. et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial Lancet; 2019; 394: 121–30. 3. Instrukcja użycia Trulicity®, lipiec 2018. |
| Informacja medyczna | Zgłoś działanie niepożądane | PP-DG-PL-0225 |
|
Ta wiadomość została wysłana przez IQVIA Technology Solutions Poland Sp. z o.o. na zlecenie Eli Lilly Polska Sp. z.o.o., Żwirki i Wigury 18a Warszawa, 02-092, Polska. Niniejsza informacja została wysłana na adresy e-mailowe lekarzy, zarejestrowanych w bazie danych, której administratorem jest IQVIA Technology Solutions Poland Sp. z o.o. (poprzednio IMS Health Technology Solutions Poland Sp. z o.o.). Zgodnie z obowiązującą Ustawą o świadczeniu usług drogą elektroniczną (t.j. Dz.U. z 2017 poz. 1219) oraz europejskim Rozporządzeniem o Ochronie Danych Osobowych 2016/679 („RODO”) (Dz.Urz.UE.L Nr 119, str. 1) przysługuje Pani/Panu w każdej chwili prawo aktualizacji swoich danych osobowych, żądania ich usunięcia, jak również zgłoszenia sprzeciwu wobec ich przetwarzania. Adres: IQVIA Technology Solutions Poland Sp. z o.o., ul. Domaniewska 48, 02-672 Warszawa. IQVIA Technology Solutions Poland Sp. z o.o. nie odpowiada za treść i formę zamieszczanych reklam. © 2019 Eli Lilly and Company. Wszystkie prawa zastrzeżone. |
|
|
NAZWA PRODUKTU LECZNICZEGO: Trulicity (dulaglutyd) 0,75 mg roztwór do wstrzykiwań we wstrzykiwaczu półautomatycznym napełnionym. Trulicity (dulaglutyd) 1,5 mg roztwór do wstrzykiwań we wstrzykiwaczu półautomatycznym napełnionym. SKŁAD JAKOŚCIOWY I ILOŚCIOWY: Trulicity 0,75 mg roztwór do wstrzykiwań. Każdy wstrzykiwacz półautomatyczny napełniony zawiera 0,75 mg dulaglutydu* w 0,5 ml roztworu. Trulicity 1,5 mg roztwór do wstrzykiwań. Każdy wstrzykiwacz półautomatyczny napełniony zawiera 1,5 mg dulaglutydu* w 0,5 ml roztworu. *Produkt wytwarzany metodą rekombinacji DNA w linii komórkowej jajnika chomika chińskiego. Wykaz substancji pomocniczych: sodu cytrynian, kwas cytrynowy bezwodny, mannitol, polisorbat 80, woda do wstrzykiwań. POSTAĆ FARMACEUTYCZNA: Roztwór do wstrzykiwań. Przezroczysty, bezbarwny roztwór. WSKAZANIA DO STOSOWANIA: Cukrzyca typu 2. Produkt leczniczy Trulicity jest wskazany w leczeniu osób dorosłych z niedostatecznie kontrolowaną cukrzycą typu 2 jako uzupełnienie diety i ćwiczeń: w monoterapii - gdy stosowanie metforminy uważa się za niewłaściwe z powodu nietolerancji lub przeciwwskazań; w leczeniu uzupełniającym - w skojarzeniu z innymi produktami leczniczymi stosowanymi w leczeniu cukrzycy. Wyniki badań dotyczące leczenia skojarzonego, wpływu na kontrolę glikemii, zdarzeń niepożądanych związanych z układem sercowo-naczyniowym i badanych populacji przedstawiono w punktach 4.4, 4.5 i 5.1 charakterystyki produktu leczniczego Trulicity. DAWKOWANIE I SPOSÓB PODAWANIA: W monoterapii - zalecana dawka wynosi 0,75 mg raz w tygodniu. W leczeniu uzupełniającym - zalecana dawka wynosi 1,5 mg raz w tygodniu. U osób szczególnie wrażliwych, takich jak pacjenci w wieku co najmniej 75 lat, można rozważyć dawkę początkową wynoszącą 0,75 mg raz w tygodniu. W przypadku dodania produktu leczniczego Trulicity do aktualnie stosowanego schematu leczenia metforminą i (lub) pioglitazonem, metforminę i (lub) pioglitazon można nadal podawać w tej samej dawce. W przypadku dodania produktu leczniczego Trulicity do aktualnie stosowanego schematu leczenia metforminą i (lub) inhibitorem kotransportera sodowo-glukozowego 2 (SGLT2), metforminę i (lub) inhibitor SGLT2 można nadal podawać w tej samej dawce. W przypadku dodania produktu leczniczego do aktualnie stosowanego schematu leczenia pochodną sulfonylomocznika lub insuliną, można rozważyć zmniejszenie dawki pochodnej sulfonylomocznika lub insuliny w celu ograniczenia ryzyka wystąpienia hipoglikemii. Nie jest konieczne samodzielne kontrolowanie przez pacjenta stężenia glukozy we krwi podczas stosowania produktu leczniczego Trulicity. Samodzielne kontrolowanie stężenia glukozy we krwi jest konieczne w celu skorygowania dawki pochodnej sulfonylomocznika lub insuliny, zwłaszcza gdy rozpoczęto leczenie produktem Trulicity i zmniejszono dawkę insuliny. Zaleca się stopniowe zmniejszanie dawki insuliny. Pacjenci w podeszłym wieku: nie jest konieczne dostosowanie dawki ze względu na wiek pacjenta. Jednak doświadczenie związane z leczeniem pacjentów w wieku co najmniej 75 lat jest bardzo ograniczone i u tych pacjentów można rozważyć dawkę początkową wynoszącą 0,75 mg raz w tygodniu. Zaburzenia czynności nerek: U pacjentów z łagodnymi, umiarkowanie ciężkimi lub ciężkimi zaburzeniami czynności nerek (eGFR <90 do ≥15 ml/min/1,73 m2) nie jest konieczne dostosowanie dawki. Doświadczenie związane z leczeniem pacjentów ze schyłkową niewydolnością nerek (<15 ml/min/1,73m2) jest bardzo ograniczone, dlatego nie można zalecać stosowania produktu leczniczego Trulicity w tej grupie pacjentów. Zaburzenia czynności wątroby: u pacjentów z zaburzeniami czynności wątroby dostosowanie dawki nie jest konieczne. Dzieci i młodzież: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności dulaglutydu u dzieci w wieku poniżej 18 lat. Nie ma dostępnych danych. Produkt leczniczy Trulicity należy wstrzykiwać podskórnie w powłoki jamy brzusznej, udo lub górną część ramienia. Produktu leczniczego nie należy podawać dożylnie ani domięśniowo. Dawkę można podać o dowolnej porze dnia, podczas posiłku lub między posiłkami. W przypadku pominięcia dawki produktu, należy ją podać możliwie najszybciej, jeśli do wyznaczonego terminu kolejnego wstrzyknięcia pozostało co najmniej 3 dni (72 godziny). Jeśli termin następnego wstrzyknięcia wypada za mniej niż 3 dni (72 godziny), pominiętą dawkę należy opuścić, a następną podać w wyznaczonym dniu. W każdym przypadku pacjenci mogą następnie powrócić do zwykłego schematu dawkowania raz w tygodniu. W razie potrzeby można zmienić wyznaczony w tygodniu dzień podawania produktu, o ile ostatnią dawkę wstrzyknięto co najmniej 3 dni (72 godziny) wcześniej. PRZECIWWSKAZANIA: Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą. SPECJALNE OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI DOTYCZĄCE STOSOWANIA: Nie należy stosować dulaglutydu u pacjentów z cukrzycą typu 1 ani w leczeniu cukrzycowej kwasicy ketonowej. Dulaglutyd nie zastępuje insuliny. U pacjentów zależnych od insuliny notowano występowanie cukrzycowej kwasicy ketonowej po gwałtownym przerwaniu podawania lub zmniejszeniu dawki insuliny. Odwodnienie: u pacjentów leczonych dulaglutydem, szczególnie na początku leczenia, zgłaszano odwodnienie, czasami prowadzące do ostrej niewydolności nerek lub nasilenia zaburzeń czynności nerek. Wiele z działań niepożądanych dotyczących nerek zgłaszano u pacjentów, u których występowały nudności, wymioty, biegunka lub odwodnienie. Należy poinformować pacjentów leczonych dulaglutydem o ryzyku odwodnienia, szczególnie w przypadku wystąpienia działań niepożądanych ze strony układu pokarmowego i zalecić środki ostrożności jakie trzeba podjąć żeby uniknąć nadmiernej utraty płynów. Nie przeprowadzono badań dulaglutydu u pacjentów z ciężkimi chorobami układu pokarmowego, w tym z ciężkim porażeniem żołądka, dlatego nie zaleca się stosowania produktu u tych pacjentów. Ostre zapalenie trzustki: stosowanie agonistów receptora GLP-1 wiązało się z ryzykiem wystąpienia ostrego zapalenia trzustki. W badaniach klinicznych zgłaszano występowanie ostrego zapalenia trzustki w związku ze stosowaniem dulaglutydu. Należy poinformować pacjentów, jakie są charakterystyczne objawy ostrego zapalenia trzustki. W przypadku podejrzenia zapalenia trzustki należy zaprzestać stosowania dulaglutydu. W razie potwierdzenia zapalenia trzustki nie należy wznawiać podawania dulaglutydu. Jeśli brak jest innych przedmiotowych i podmiotowych objawów ostrego zapalenia trzustki, samo zwiększenie aktywności enzymów trzustkowych nie jest czynnikiem predykcyjnym wystąpienia ostrego zapalenia trzustki. Hipoglikemia: u pacjentów przyjmujących dulaglutyd w skojarzeniu z pochodną sulfonylomocznika lub insuliną możliwe jest zwiększenie ryzyka wystąpienia hipoglikemii. Ryzyko hipoglikemii można obniżyć zmniejszając dawkę pochodnej sulfonylomocznika lub insuliny. Niebadane grupy pacjentów: doświadczenie związane z leczeniem pacjentów z zastoinową niewydolnością serca jest ograniczone. Zawartość sodu: Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) na dawkę wynoszącą 1,5 mg, to znaczy lek uznaje się za „wolny od sodu”. DZIAŁANIA NIEPOŻĄDANE: Podsumowanie profilu bezpieczeństwa: W zakończonych badaniach rejestracyjnych fazy II i fazy III, 4 006 pacjentów stosowało dulaglutyd w monoterapii lub w skojarzeniu z innymi produktami leczniczymi o działaniu hipoglikemizującym. Do działań niepożądanych najczęściej zgłaszanych w badaniach klinicznych należały objawy ze strony przewodu pokarmowego, w tym nudności, wymioty i biegunka. Na ogół działania te miały łagodne lub umiarkowane nasilenie oraz przemijający charakter. Tabelaryczne zestawienie działań niepożądanych: Wymienione niżej działania niepożądane zostały zidentyfikowane na podstawie oceny danych zebranych w czasie trwania badań klinicznych fazy II i fazy III oraz zgłoszeń otrzymanych po wprowadzeniu produktu leczniczego do obrotu i ujęte w Tabeli 1 według określeń preferowanych w słowniku MedDRA oraz klasyfikacji układów i narządów, zgodnie ze zmniejszającą się częstością występowania (bardzo często: ≥ 1/10; często: od ≥1/100 do <1/10; niezbyt często: od ≥1/1000 do <1/100; rzadko: od ≥ 1/10 000 do < 1/1000; bardzo rzadko: < 1/10 000 i częstość nieznana: częstość nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania działania niepożądane są przedstawione zgodnie ze zmniejszającą się częstością.
Tabela 1: Częstość występowania działań niepożądanych dulaglutydu
# Na podstawie zgłoszeń otrzymanych po wprowadzeniu produktu leczniczego do obrotu. * Udokumentowana, objawowa hipoglikemia ze stężeniem glukozy we krwi ≤ 3,9 mmol/l † Tylko w przypadku dulaglutydu w dawce 1,5 mg. Wprzypadku dulaglutydu w dawce 0,75 mg to działanie niepożądane występuje z częstością ustaloną dla grupy o niższej częstości występowania. Opis wybranych działań niepożądanych Hipoglikemia: w przypadku stosowania dulaglutydu w dawce 0,75 mg i 1,5 mg w monoterapii lub w skojarzeniu z metforminą lub z metforminą i pioglitazonem częstość występowania udokumentowanych przypadków objawowej hipoglikemii wynosiła od 5,9% do 10,9%, wskaźnik występowania hipoglikemii mieścił się w zakresie od 0,14 do 0,62 zdarzeń przypadających na pacjenta na rok i nie zgłoszono wystąpienia ciężkiej hipoglikemii. Częstość występowania udokumentowanej objawowej hipoglikemii w przypadku stosowania dulaglutydu w dawce 0,75 mg i 1,5 mg w skojarzeniu z pochodną sulfonylomocznika i metforminą wyniosła odpowiednio 39,0% i 40,3%, a wskaźniki występowania hipoglikemii wyniosły odpowiednio 1,67 i 1,67 zdarzeń przypadających na pacjenta na rok. Częstość występowania ciężkiej hipoglikemii wyniosła 0% i 0,7%, a wskaźniki występowania ciężkiej hipoglikemii wyniosły 0,00 i 0,01 zdarzeń przypadających na pacjenta na rok odpowiednio dla każdej dawki. Częstość występowania przypadków udokumentowanej objawowej hipoglikemii podczas stosowania dulaglutydu 1,5 mg z samym sulfonylomocznikiem wynosiła 11,3%, a wskaźnik wynosił 0,90 zdarzenia przypadającego na pacjenta w ciągu roku; nie odnotowano epizodów ciężkiej hipoglikemii. Częstość występowania przypadków udokumentowanej objawowej hipoglikemii podczas stosowania dulaglutydu 1,5 mg w skojarzeniu z insuliną glargine wynosiła 35,3%, a wskaźnik wynosił 3,38 zdarzenia przypadającego na pacjenta w ciągu roku. Częstość występowania epizodów ciężkiej hipoglikemii wyniosła 0,7%, a wskaźniki występowania ciężkiej hipoglikemii wyniósł 0,01 zdarzenia przypadającego na pacjenta na rok. W przypadku stosowania dulaglutydu w dawce 0,75 mg i 1,5 mg w skojarzeniu z insuliną posiłkową, częstość występowania ciężkiej hipoglikemii wyniosła odpowiednio 85,3% i 80,0%, a wskaźniki występowania ciężkiej hipoglikemii wyniosły 35,66 i 31,06 zdarzeń przypadających na pacjenta na rok. Częstość występowania ciężkiej hipoglikemii wyniosła 2,4% i 3,4%, a wskaźniki występowania ciężkiej hipoglikemii wyniosły 0,05 i 0,06 zdarzeń przypadających na pacjenta na rok. Działania niepożądane ze strony przewodu pokarmowego: do objawów ze strony przewodu pokarmowego, zgłoszonych w okresie do 104 tygodni przyjmowania dulaglutydu w dawce wynoszącej odpowiednio 0,75 mg i 1,5 mg, należały nudności (12,9% i 21,2%), biegunka (10,7% i 13,7%) oraz wymioty (6,9% i 11,5%). Zazwyczaj ich nasilenie było łagodne lub umiarkowane, pojawiły się najczęściej w ciągu pierwszych 2 tygodni leczenia, a w ciągu następnych 4 tygodni ich liczba szybko się zmniejszała. Po tym czasie wskaźnik występowania tych działań niepożądanych utrzymywał się na stosunkowo stałym poziomie. W klinicznych badaniach farmakologicznych przeprowadzonych z udziałem pacjentów z cukrzycą typu 2 w okresie do 6 tygodni, większość objawów ze strony przewodu pokarmowego zgłoszono w ciągu pierwszych 2-3 dni po podaniu pierwszej dawki, a ich liczba zmniejszała się w miarę przyjmowania kolejnych dawek leku. Ostre zapalenie trzustki: częstość występowania ostrego zapalenia trzustki w badaniach klinicznych fazy II i fazy III wyniosła 0,07% w przypadku stosowania dulaglutydu, 0,14% w przypadku stosowania placebo i 0,19% w przypadku stosowania komparatorów w monoterapii lub jednocześnie z dodatkowym podstawowym leczeniem przeciwcukrzycowym. Enzymy trzustkowe: stosowanie dulaglutydu wiąże się ze wzrostem stężeń enzymów trzustkowych (lipazy i/lub amylazy trzustkowej) średnio o 11% do 21% w stosunku do wartości wyjściowych. Jeśli brak jest innych przedmiotowych i podmiotowych objawów ostrego zapalenia trzustki, samo zwiększenie aktywności enzymów trzustkowych nie jest czynnikiem predykcyjnym wystąpienia ostrego zapalenia trzustki. Wzrost częstości akcji serca: podczas stosowania dulaglutydu w dawce wynoszącej odpowiednio 0,75 mg i 1,5 mg obserwowano niewielki wzrost częstości akcji serca średnio o 2 do 4 uderzeń na minutę oraz częstości występowania tachykardii zatokowej o 1,3% i 1,4%, z jednoczesnym przyspieszeniem akcji serca o ≥ 15 uderzeń na minutę w stosunku do częstości wyjściowej. Blok przedsionkowo-komorowy pierwszego stopnia/wydłużenie odstępu PR: podczas stosowania dulaglutydu w dawce wynoszącej odpowiednio 0,75 mg i 1,5 mg obserwowano nieznaczne wydłużenie odstępu PR o 2 do 3 milisekund w stosunku do wartości wyjściowej oraz wzrost częstości występowania bloku przedsionkowo-komorowego pierwszego stopnia o 1,5% i 2,4%. Immunogenność: w badaniach klinicznych, częstość występowania związanych z leczeniem przeciwciał przeciwko dulaglutydowi wynosiła 1,6%, co wskazuje na to, że zmiany w budowie cząsteczki GLP-1 i modyfikacja fragmentu IgG4 stanowiącego część cząsteczki dulaglutydu wraz z wysokim stopniem podobieństwa do naturalnego białka GLP-1 i naturalnej immunoglobuliny IgG4 przyczyniają się do zmniejszenia ryzyka wystąpienia odpowiedzi immunologicznej skierowanej przeciwko dulaglutydowi. Miano przeciwciał przeciwko dulaglutydowi było na ogół niskie i chociaż przeciwciała takie wykrywano u niewielkiej liczby pacjentów, analiza danych z badań fazy III wykazała brak wyraźnego wpływu przeciwciał skierowanych przeciwko dulaglutydowi na zmiany wartości HbA1c. U żadnego pacjenta z nadwrażliwością o charakterze ogólnoustrojowym nie wykazano obecności przeciwciał skierowanych przeciwko dulaglutydowi. Nadwrażliwość: W badaniach klinicznych fazy II i fazy III przypadki występowania ogólnej nadwrażliwości (np. pokrzywki, obrzęku) zgłoszono u 0,5% pacjentów otrzymujących dulaglutyd. Przypadki reakcji anafilaktycznych były zgłaszane rzadko podczas stosowania dulaglutydu po wprowadzaniu do obrotu. Odczyny w miejscu wstrzyknięcia: Występowanie odczynów w miejscu wstrzyknięcia leku zgłoszono u 1,9% pacjentów otrzymujących dulaglutyd. Zdarzenia niepożądane o potencjalnym podłożu immunologicznym w postaci odczynów w miejscu wstrzyknięcia (np. wysypkę, rumień) zgłoszono u 0,7% pacjentów. Zazwyczaj były to objawy łagodne. Rezygnacja z leczenia z powodu wystąpienia zdarzeń niepożądanych: w badaniach trwających 26 tygodni częstość występowania przypadków rezygnacji z przyjmowania leku z powodu wystąpienia zdarzeń niepożądanych wyniosła 2,6% (0,75 mg) i 6,1% (1,5 mg) u osób przyjmujących dulaglutyd oraz 3,7% u osób otrzymujących placebo. Przez cały czas trwania badania (do 104 tygodni) częstość występowania przypadków rezygnacji z przyjmowania leku z powodu wystąpienia zdarzeń niepożądanych wynosiła 5,1% (0,75 mg) i 8,4% (1,5 mg) w grupie leczonej dulaglutydem. Do najczęściej zgłaszanych działań niepożądanych prowadzących do rezygnacji z leczenia dulaglutydem w dawce wynoszącej odpowiednio 0,75 mg i 1,5 mg należały nudności (1,0%, 1,9%), biegunka (0,5%, 0,6%) i wymioty (0,4%, 0,6%). Na ogół zdarzenia te zgłaszano w ciągu pierwszych 4-6 tygodni. Zgłaszanie podejrzewanych działań niepożądanych: po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandia. NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU WYDANE PRZEZ KOMISJĘ EUROPEJSKĄ: EU/1/14/956/001-008 DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA OSTATNIEGO PRZEDŁUŻENIA POZWOLENIA: 21 listopada 2014. Szczegółowe informacje o tym produkcie leczniczym są dostępne na stronie internetowej Europejskiej Agencji Leków http://www.ema.europa.eu KATEGORIA DOSTĘPNOŚCI: Produkt leczniczy wydawany na receptę. Pełna Informacja o leku dostępna jest w Eli Lilly Polska Sp. z o.o. , ul. Żwirki i Wigury 18A, 02-092 Warszawa, tel.: +48 22 440 33 00, faks +48 22 440 35 53, www.lilly.pl. Informacja opracowana na podstawie Charakterystyki Produktu Leczniczego z dnia 21/10/2019. Przed przepisaniem leku należy zapoznać się z Charakterystyką Produktu Leczniczego. Materiał promocyjny przeznaczony dla osób uprawnionych do wystawiania recept lub osób prowadzących obrót produktami leczniczymi. Opracowano w dniu 22.10.2019. |